FYTOTHERAPIE TER ONDERSTEUNING VAN DE DARMBARRIÈRE
Uit: Nederlands Tijdschrift voor Fytotherapie 2019 nr. 3
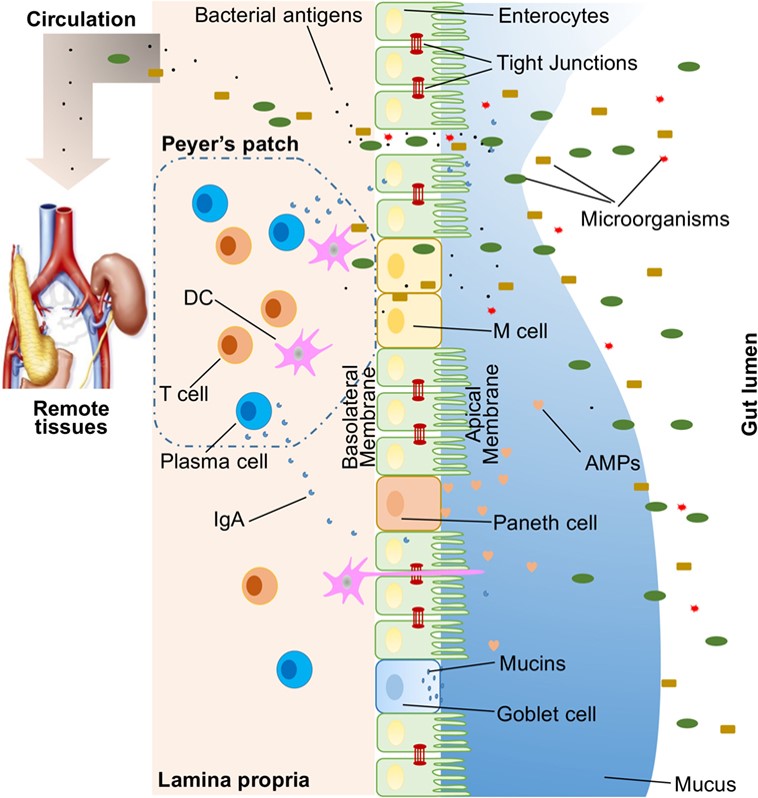
CINDY DE WAARD | Bepaalde planten, plantenstoffen en paddenstoelen kunnen directe en indirecte effecten hebben op het functioneren van de darmwand. Door positieve beïnvloeding van het microbioom kan de belasting van de darmwand en het immuunsysteem afnemen, wat herstel mogelijk maakt. Ook kunnen sommige planten ontstekingsremmend werken, de schadelijke invloed van vrije radicalen beperken, de gezonde slijmlaag in de darmen herstellen en de tight junction-eiwitten tussen de darmepitheelcellen versterken. Dit maakt het gebruik van bepaalde kruiden interessant bij verschillende chronische aandoeningen en ontstekingsziekten in de darm. In het artikel Inleiding in de darmbarrière kunt u in vogelvlucht lezen hoe de darmwand is opgebouwd en welke rol het afweersysteem speelt bij de instandhouding van een goede darmbarrière. In dit artikel wordt dieper ingegaan op enkele geneeskrachtige planten die de darmwand bij zijn belangrijke functie kunnen ondersteunen.
Een planteninhoudsstof kan op verschillende manieren invloed uitoefenen op de darmbarrière. Een van de belangrijkste effecten die bepaalde planten kunnen hebben, is de stimulatie van de vorming van mucines door de darmwand. Met andere woorden: verschillende plantenstoffen zijn in staat om de beschermende slijmlaag die op de darmwand ligt te herstellen. Hierdoor wordt niet alleen de invloed van ongunstige bacteriën en stoffen uit voeding beperkt, maar worden tevens de microvilli, die verantwoordelijk zijn voor de oppervlaktevergroting in de darm en de opname van voedingsstoffen, beschermd. Een ander mechanisme waarop planten invloed kunnen hebben, is via de tight junction-eiwitten. Plaatstoffen kunnen de verbindingen tussen de epitheelcellen herstellen, waardoor een ‘lekkende darm’ (gedeeltelijk) kan worden opgeheven (zie elders in dit nummer).
Alle bovengenoemde effecten vinden plaats doordat deze plantenstoffen direct invloed uitoefenen op een of meerdere eiwitten of cellen in de darmwand. Er zijn echter ook indirecte effecten denkbaar. Planten kunnen bijvoorbeeld een prebiotische functie hebben. Dat wil zeggen dat ze een aanwezige disbalans in het darmmicrobioom kunnen verbeteren door de groei van gunstige bacteriën te stimuleren. Ook zijn er planten die de productie van korteketenvetzuren, waaronder butyraat, door deze gunstige darmflora kunnen stimuleren. Butyraat is de belangrijkste energieleverancier voor de epitheelcellen in de darmwand, waardoor deze cellen zich beter kunnen herstellen. Tot slot kunnen sommige planten of plantenstoffen direct of indirect via het microbioom het immuunsysteem beïnvloeden, waardoor ontstekingsremmende effecten de cellen in de darmwand in staat stellen zich te herstellen.
Er bestaat dus een scala aan mogelijkheden waarop de darmwand beïnvloed kan worden. In dit artikel ligt de focus op de directe effecten van bepaalde planten, plantenstoffen en paddenstoelen op de darmbarrière en de beïnvloeding van de productie van korteketenvetzuren.
GEMBER

Gember (Zingiber officinale L.) is een ontstekingsremmend plant. De werkzame stof zingerone zorgt zowel voor remming van ontstekingsbevorderende stoffen als voor het wegvangen van potentieel schadelijke vrije radicalen door middel van het stimuleren van het lichaamseigen antioxidantsysteem. Deze eigenschappen hebben van zichzelf al een regulerend effect op het functioneren van de darmwand, maar gember doet mogelijk meer. Het is in staat om de tight functions tussen de epitheelcellen te beïnvloeden tijdens een ontsteking. Een ontsteking verhoogt onder andere de hoeveelheid ontstekingsbevorderende tumor necrosis factor-α (TNF-α), wat tevens de doorlaatbaarheid van de darm verhoogt door de regulatie van de tight junction-eiwitten te verstoren. In vitro-onderzoek in humane darmcellen heeft aangetoond dat het 6-shogaol uit de gemberwortel deze verstoring tegengaat, waardoor de darmintegriteit tijdens een ontsteking beter behouden blijft [2,3]. Dit zou gember bij uitstek geschikt maken voor de toepassing bij actieve ontstekingen in de darm, zoals bij een opvlamming van de ziekte van Crohn of colitis ulcerosa.
BERBERINE, QUERCETIN EN GENISTEÏN
Berberine (een alkaloïde) wordt sinds tijden succesvol gebruikt bij gastro-enteritis en diarree. Recentelijk wordt het tevens ingezet bij diabetes type 2 en een verhoogd cholesterolgehalte. Bij al deze aandoeningen spelen ontstekingsprocessen en de doorlaatbaarheid van de darmwand een rol. Uit verschillende in vitro-onderzoeken blijkt dat ook berberine in staat is om de ongunstige effecten van TNF-α op de darmdoorlaatbaarheid te remmen. Een onderzoek bij ratten met diabetes type 2 liet zien dat een hoge concentratie berberine van 375 mg per kg lichaamsgewicht per dag positieve effecten had op de glucose- en cholesterolspiegels en een lekkende darm met 27,5% kon verminderen.
Tot slot laat een onderzoek uitgevoerd met darmbacteriën zien dat berberine de productie van korteketenvetzuren verhoogt met 10-50%. De effecten van berberine, zeker bij aandoeningen zoals diabetes type 2 en het metabool syndroom, zijn dan ook divers. De stof beïnvloedt het hormonale systeem, het immuunsysteem, de vetstofwisseling en daarmee ook het darmmicrobioom en de darmwand [4-7].
Met het gebruik van de flavonoïden quercetin en genisteïn werden soortgelijke effecten gezien op de regulatie van de tight junction-eiwitten. De effecten van berberine, quercetin en genisteïn op de darmwand komen met name tot uiting bij gebruik van een voedingspatroon dat hoog is in vet en geraffineerde suikers, het zogenaamde westerse voedingspatroon. Quercetin verlaagt bij dergelijke voeding de ontstekingsgraad in de darmen en de lever en vermindert de oxidatie van vetten. Er zijn dan ook positieve effecten gezien bij het gebruik van deze stof bij niet-alcoholische leververvetting [8,9].
GROENE THEE

Het epigallocatechin-3-gallaat (EGCG) uit groene thee (Camellia sinensis (L.) Kuntze) vertoont antioxidatieve effecten in de darmen. Door de stimulatie van het lichaamseigen antioxidantsysteem is de darmwand beter beschermd tegen erosie die ontstaat door inwerking van vrije radicalen.
Dit effect wordt versterkt doordat EGCG tevens de slijmproductie stimuleert, waardoor de gezonde slijmlaag op het darmepitheel intact blijft en ongunstige invloeden minder makkelijk op de darmwand kunnen inwerken. Tot slot dempt groene thee de ontstekingsbevorderende reactie bij ontstekingsgerelateerde auto-immuunziekten. Dit maakt groene thee wellicht een interessante therapie bij de ziekte van Crohn [10,11].
OLIBANUM
Olibanum, de hars van de wierookboom (Boswellia serrata Roxb. ex Colebr.), wordt soms ingezet bij gewrichtsklachten en ontstekingsgerelateerde aandoeningen in de darmen. Met name het 11-keto-β-boswelliazuur en acetyl-11-keto-β-boswelliazuur zijn verantwoordelijk voor de geobserveerde ontstekingsremmende effecten. Tot op heden zijn drie klinische studies naar het gebruik van olibanum bij inflammatoire darmziekten uitgevoerd, met een gebruikte dosering vari.rend van 300 mg tot 1200 mg per dag. Ondanks dat deze studies klein van opzet waren, leveren ze voorzichtige positieve resultaten en bleek de hars in potentie even effectief als de standaardtherapie bij deze aandoeningen.

Uit verschillende experimentele dierstudies lijkt naar voren te komen dat de boswelliazuren hun ontstekingsremmende effecten uitoefenen via remming van het 5-lipoxygenase, een enzym dat betrokken is bij de omzetting van het ontstekingsbevorderende omega-6 vetzuur arachidonzuur, maar dit kan niet bevestigd worden in klinische studies. Een daling van de activiteit van dit enzym bij mensen leidt echter niet altijd tot een vermindering van de klachten. In klinische studies is wel een ander effect van olibanum gevonden, namelijk een afname van de infiltratie van leukocyten in de darm en een remming van de ontstemingsbevorderende transcriptiefactor NF-kB. Wetenschappers verklaren dit effect door de lage biologische beschikbaarheid van boswelliazuren waardoor de hars in de gebruikte doseringen mogelijk een lokaal effect in de darmen heeft (en dus niet systemisch).
De gevonden effecten in klinische studies maken olibanum mogelijk interessant als vervangingstherapie bij gebruik van aminosalicylaten, corticostero.den en niet-steroïde anti-inflammatoire medicijnen (NSAID’s), omdat de hars in tegenstelling tot deze medicatie weinig bijwerkingen geeft [12,13].
ZOETHOUTWORTEL
Het 18β-glycyrrhetinezuur (18β-GZ) uit de zoethoutwortel (Glycyrrhiza glabra L.) is in staat om de groei van verschillende ongunstige micro-organismen in de darm te remmen, waaronder de gist Candida albicans en ongunstige Escherichia coli-bacteriën.

Het ontstekingsremmende effect van de wortel wordt ook met name veroorzaakt door het 18β-GZ, door het verminderen van de belasting met ongunstige micro-organismen in de darmen en het remmen van het vrijkomen van TNF-α. Het 18β-GZ wordt door de darmmicrobiota gevormd uit glycyrrhizine. Het glycyrrhizine zelf heeft ook invloed op de darmwand: het stimuleert namelijk de slijmproductie, waardoor de darmwand beter beschermd wordt tegen inwerking van ongunstige invloeden [14,15].
CRANBERRY

Proanthocyanidinen uit cranberry (Vaccinium spp.) blijken in twee sierstudies in staat om zowel de slijmlaag op de darmwand te herstellen, als om het immuunsysteem in de darm te stimuleren. De gebruikte proefdieren kregen sondevoeding toegediend. Dit type voeding staat erom bekend om verstoringen in de darmintegriteit te veroorzaken. Door toevoeging van proanthocyanidin en uit cranberry verbeterde zowel de opbouw van de darmwand als de afweerreactie. Klinische studies moeten nog uitwijzen of dit effect ook bij mensen optreedt. Bepaalde fenolen uit cranberry blijken in een in vitro-studie oxidatieve stress en ontsteking te verminderen via de remming van TNF-α [16,17]. Tegelijkertijd wordt mitochondriale disfunctie voorkomen, waardoor de energiecentrales van de cel goed blijven functioneren. Dat komt de celfunctie ten goede [18]. Belangrijk bij het eventuele gebruik van cranberryextract voor herstel van de darmwand is het gebruik van een preparaat met zo min mogelijk organische zuren. In vitro-onderzoek heeft namelijk uitgewezen dat deze stoffen juist ongunstig zijn voor de integriteit van de darmwand [19].
PADDENSTOELEN
Paddenstoelen worden met name gebruikt voor hun effecten op het immuunsysteem. Ze kunnen echter ook specifieke effecten in het darmkanaal hebben. Zo zijn polysachariden uit reishi-mycelium (Ganoderma lingzhi en G. lucidum) in staat om de totale hoeveelheid korteketenvetzuren te verhogen en de darmwand te versterken door het aantal tight junction-eiwitten tussen de epitheelcellen te verhogen. Het gebruik van G. lucidum zorgde bij ratten tevens voor een diverser darmmicrobioom. Dat wordt geassocieerd met een betere gezondheid [20,21]. Cordyceps sinensis tot slot, is in staat om de integriteit van de darmwand te stabiliseren bij (dreigende) sepsis in een diermodel met ratten. Hier bleek het gebruikte paddenstoelenextract in staat om de geprogrammeerde celdood van darmepitheelcellen te voorkomen en juist de groei van de epitheelcellen te stimuleren in aanwezigheid van endotoxinen [22].
CONCLUSIE
Onderzoeken om het precieze werkingsmechanisme en de werkzame plantenstoffen in relatie tot de darmfunctie in kaart te brengen bestaan voornamelijk uit in vitro-studies of dierstudies. Slechts enkele klinische studies zijn uitgevoerd, waarbij de werking van de betreffende planten met name onderzocht is bij ontstekingsaandoeningen in de darmen. Deze ziekten,
waaronder inflammatoire darmziekten, gaan namelijk in de regel gepaard met een verlies van de darmintegriteit. De verschillende studies die zijn gedaan, laten zien dat de werking van planten en specifieke plantenstoffen soms verder reikt dan tot nu toe gedacht werd. In plaats van uitsluitend effecten op het immuunsysteem, lijken er ook invloeden te zijn op de darmwand in het bijzonder. Met name beïnvloeding van de tight junction-eiwitten, het stimuleren van de slijmproductie en de antioxidatieve effecten spelen hierin mogelijk een sleutelrol. Omdat een disfunctie van de darmwand ook bij andere chronische aandoeningen wordt gevonden dan bij inflammatoire darmaandoeningen alleen, kunnen de genoemde planten in de praktijk mogelijk ook breder ingezet worden. Dat maakt deze verschillende geneeskruiden een mogelijk waardevolle aanwinst bij de behandeling van uiteenlopende chronische aandoeningen waarbij een disfunctie van de darmbarrière een rol speelt.
AUTEURSGEGEVENS | Drs. C. (Cindy) de Waard is farmaceutisch wetenschapper en natuurgeneeskundige. Ze werkt als freelance medisch tekstschrijver en heeft een complementaire praktijk gespecialiseerd in darmgezondheid. Tevens is zij redactielid van dit tijdschrift. Reacties: cindy@jouwgezondedarmen.nl.
REFERENTIES | [1] Gibson GR et al. Dietary modulation of the human colonic microbiota: introducing the concept of prebiotics. J Nutr. 1995;125(6):1401-1412. [2] Luettig J et al. The ginger component 6-shogaol prevents TNF-α-induced barrier loss via inhibition of PI3K/Akt and NF-κB signaling. Mol Nutr Food Res. 2016;60(12):2576–2586. [3] Kim Y et al. Ginger extract suppresses inflammatory response and maintains barrier function in human colonic epithelial Caco-2 cells exposed to inflammatory mediators. J Food Sci. 2017;82(5):1264–70. [4] Wang L-L et al. Comprehensive evaluation of SCFA production in the intestinal bacteria regulated by berberine using gas-chromatography combined with polymerase chain reaction. J ChromatogrB. 2017;1057:70–80. [5] Gong J et al. Berberine attenuates intestinal mucosal barrier dysfunction in type 2 diabetic rats. Front Pharmacol. 2017;8:42. [6] Amasheh M et al. TNFalpha-induced and berberine-antagonized tight junction barrier impairment via tyrosine kinase, Akt and NF-kappaB signaling. J Cell Sci. 2010;123(Pt 23):4145–4155. [7] Cao M et al. Amelioration of IFN-γand TNF-α-induced intestinal epithelial barrier dysfunction by berberine via suppression of MLCK-MLC phosphorylation signaling pathway. PLoS One. 2013;8(5):e61944. [8] Suzuki T et al. Role of flavonoids in intestinal tight junction regulation. J Nutr Biochem. 2011;22(5):401–408. [9] Porras D et al. Protective effect of quercetin on high-fat diet-induced non-alcoholic fatty liver disease in mice is mediated by modulating intestinal microbiota imbalance and related gut-liver axis activation. Free Radic Biol Med. 2017;102:188–202. [10] Watson J et al. Green tea polyphenol (−)-epigallocatechin gallate blocks epithelial barrier dysfunction provoked by IFN-γbut not by IL-4. Am J Physiol Liver Physiol. 2004;287(5):G954–61. [11] Song J et al. The effect of epigallocatechin-3-gallate on small intestinal morphology, antioxidant capacity and anti-inflammatory effect in heat-stressed broilers. J Anim Physiol Anim Nutr. 2019 Available from: http://doi.wiley. com/10.1111/jpn.13062. [12] Catanzaro D et al. Boswellia serrata preserves intestinal epithelial barrier from oxidative and inflammatory damage. PLoS One. 2015;10(5):e0125375. [13] Abdel-Tawab M et al. Boswellia serrata. Clin Pharmacokinet. 2011;50(6):349–369. [14] Ishida T et al. Effect of 18β-glycyrrhetinic acid and hydroxypropyl-γcyclodextrin complex on indomethacin-induced small intestinal injury in mice. Eur J Pharmacol. 2013;714(1-3):125-131. [15] Marisa R et al. Assessment report on Glycyrrhiza glabra L. and/or Glycyrrhiza inflata Bat. and/or Glycyrrhiza uralensis Fisch., radix [Internet]. [cited 2019 Jun 14]. Available from: www.ema.europa.eu. [16] Pierre JF et al. Cranberry proanthocyanidins improve the gut mucous layer morphology and function in mice receiving elemental enteral nutrition. J Parenter Enter Nutr. 2013;37(3):401-409. [17] Pierre JF et al. Cranberry proanthocyanidins improve intestinal sIgA during elementalenteral nutrition. J Parenter Enter Nutr. 2014;38(1):107-114. [18] Denis M-C et al. Prevention of oxidative stress, inflammation and mitochondrial dysfunction in the intestine by different cranberry phenolic fractions. Clin Sci (Lond). 2015;128(3):197-212. [19] Serre E et al. Deacidification of cranberry juice protects against disruption of in-vitrointestinal cell barrier integrity J Funct Food. 2016;26:208-216. [20] Feng W et al. Gut microbiota, short-chain fatty acids, and herbal medicines. Front Pharmacol. 2018;9:1354. Available from: www.ncbi.nlm.nih.gov/pubmed/30532706[21] Jin M et al. Effects of polysaccharide from mycelia of Ganoderma lucidum on intestinal barrier functions of rats. Int J Biol Macromol. 2017;94:1–9. [22] Gu G-S et al. Cordyceps sinensis preserves intestinal mucosal barrier and may be an adjunct therapy in endotoxin-induced sepsis rat model: a pilot study. Int J Clin Exp Med. 2015;8(5):7333-7341.







